Agencias
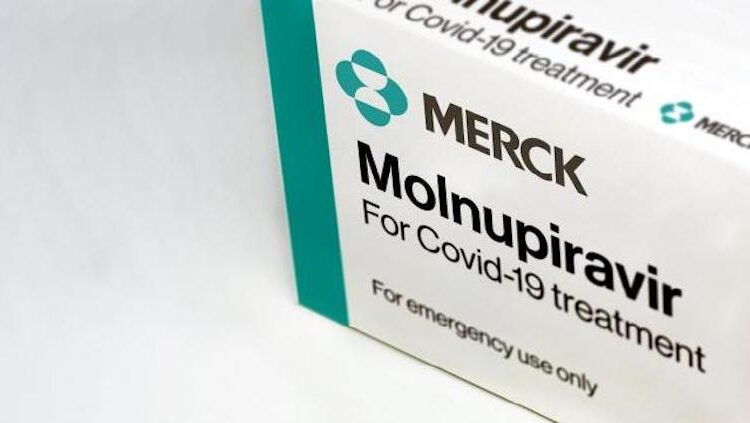
La FDA, autoridad reguladora de medicamentos en Estados Unidos, autorizó la píldora de Merck contra el Covid-19, la segunda después de la de Pfizer.
La autorización de la Administración de Alimentos y Medicamentos (FDA), de Estados Unidos, aprobó el uso de la píldora de Merck contra el coronavirus, un día después de la de Pfizer.
“Hoy, la Administración de Drogas y Alimentos de EE. UU. Emitió una autorización de uso de emergencia (EUA) para el molnupiravir de Merck para el tratamiento de la enfermedad por coronavirus leve a moderada (COVID-19) en adultos con resultados positivos de la prueba viral”, mencionó la FDA.
La píldora de Merck, presenta resultados altamente positivos en pacientes mayores con Covid-19, así como de alto riesgo.
FDA destacó que la píldora no está aprobada para el uso en menores de 18 años, únicamente en adultos mayores.
“La autorización de hoy brinda una opción de tratamiento adicional contra el virus COVID-19 en forma de píldora que se puede tomar por vía oral. Molnupiravir se limita a situaciones en las que otros tratamientos autorizados por la FDA para COVID-19 son inaccesibles o no son clínicamente apropiados y será una opción de tratamiento útil para algunos pacientes con COVID-19 con alto riesgo de hospitalización o muerte”, puntualizó la FDA.